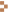| 予備申請 | 予備申請用書類を提出して下さい。 締切:IRBの前々月末 |
臨床研究推進部CRCユニット |
|---|

| ヒアリング | 薬剤師・看護師・検査技師・(医務課職員)が参加します。 修正をお願いした書類は指定期日までに再提出して下さい。 |
臨床研究推進部CRCユニット |
|---|

| 本申請 | 本申請用書類を提出して下さい。 締切:IRBの2週間前 |
研究推進掛 |
|---|

| IRB | 治験審査委員会は毎月第4週に開催します。 | |
|---|---|---|

| 治験スタッフ ミーティング |
実施手順について詳細な打ち合わせを行います。 (治験コーディネーター、検査技師、薬剤師) |
臨床研究推進部CRCユニット |
|---|

| 契約締結 | 複数年契約に対応しています。 締結時期:通常の場合はIRB開催月下旬-翌月上旬 |
研究推進掛 |
|---|

| (試験薬搬入) | 搬入前に試験薬管理手順書を提出して下さい。 (試験薬搬入がある場合のみ) |
臨床研究推進部CRCユニット |
|---|

| スタートアップ ミーティング |
治験担当医師等の関係者が一同に会し、試験実施の最終打ち合わせを行います。 |
|---|

| 試験開始 | ||
|---|---|---|
* ヒアリングの結果次第では本申請を保留していただく場合があります。
直近のIRB審議となりませんので、ご了承下さい。
直近のIRB審議となりませんので、ご了承下さい。